안녕하세요, 약사 출신 제약바이오 전문변호사 이일형입니다. 😊
신약 하나를 시장에 내놓기 위해 우리 실무진분들, 정말 고생 많으시죠? 식약처 허가받으랴, 심평원 급여 평가 넘으랴, 마지막엔 공단과 약가 협상까지… 산 넘어 산이라는 말이 딱 어울리는 과정입니다. 특히 이 모든 과정을 순차적으로 밟다 보면 시간이 하염없이 흘러가서 속타는 경우가 한두 번이 아니었을 거예요.
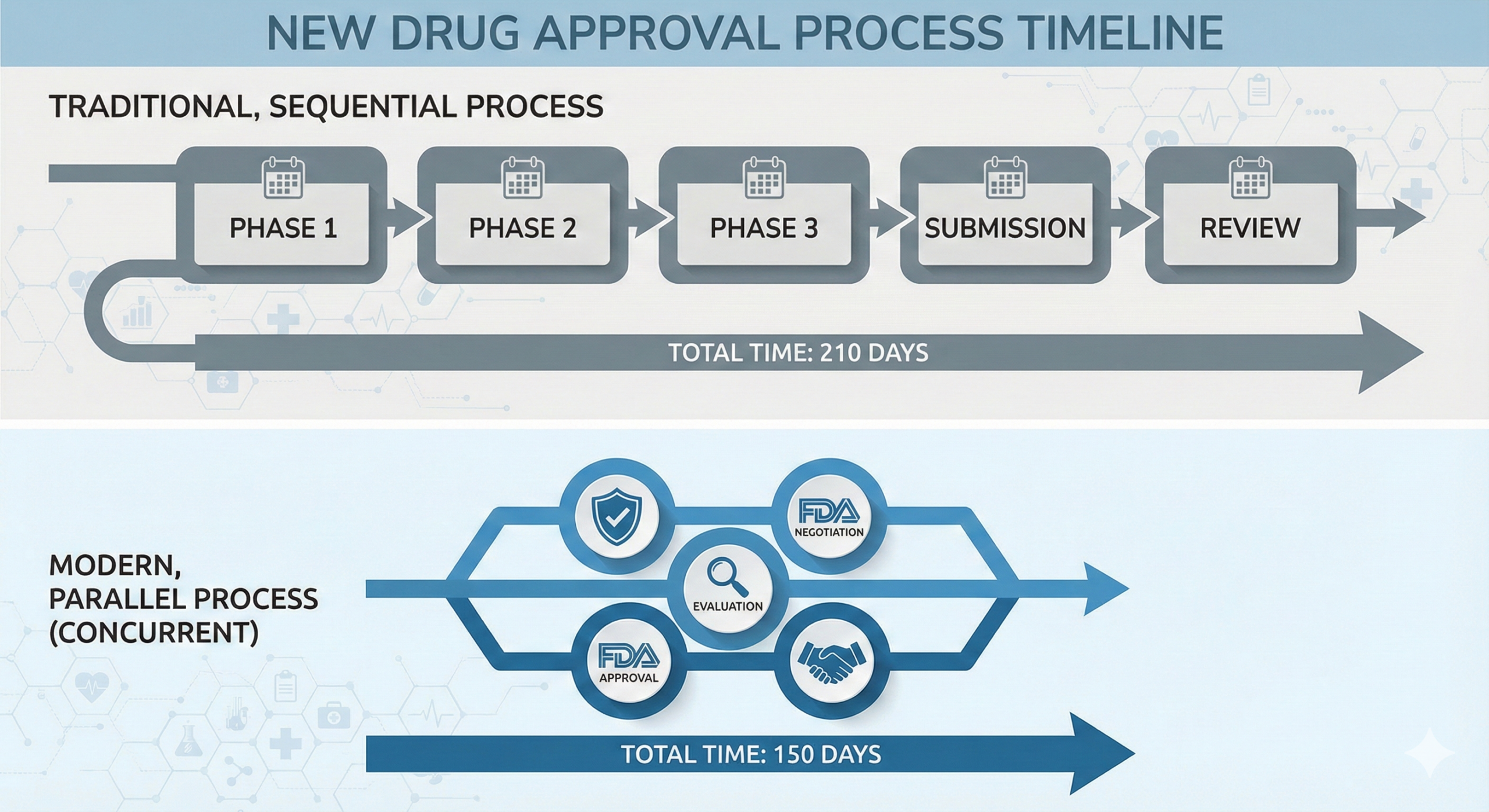
그런데 최근, 제약업계에 정말 반가운 바람이 불고 있어요. 바로 ‘허가-평가-협상 병행제도’ 시범사업이 성과를 내고 있다는 소식인데요. 약 7개월(210일)이나 걸리던 등재 기간을 5개월(150일) 안팎으로 줄일 수 있다니, 이건 정말 놓칠 수 없는 기회 아닐까요? 오늘은 이 제도가 실무 현장에 어떤 변화를 가져오고 있는지, 우리가 무엇을 준비해야 하는지 꼼꼼하게 짚어드릴게요.
1. 병렬 프로세스로의 혁신적 전환 🤔
기존 시스템은 ‘이어달리기’였어요. 식약처 허가가 끝나야 심평원 평가를 하고, 그게 끝나야 공단 협상을 했죠. 하지만 이번에 도입된 병행제도는 ‘2인 3각’ 경기처럼 각 기관이 동시에 움직이는 시스템이에요.
2023년 10월부터 시작된 이 시범사업의 핵심은 식약처 허가 신청 단계부터 급여 평가와 약가 협상을 연계한다는 점입니다. 불필요한 대기 시간을 없애고, 환자들에게는 더 빨리 치료 기회를 제공하겠다는 정부의 강력한 의지가 담겨 있죠.
기존 등재 기간 대비 약 30~60일 단축 효과가 발생합니다. 이는 제약사에게는 조기 매출 확보를, 환자에게는 생명 연장의 기회를 의미하는 ‘Win-Win’ 전략입니다.
2. Before & After: 무엇이 달라졌나? 📊
실무자 입장에서 가장 체감되는 변화는 역시 ‘기간’과 ‘절차’일 텐데요. 구체적으로 어떤 부분이 효율화되었는지 표로 정리해 보았어요. 한눈에 비교해 보세요.
| 구분 | 기존 등재 절차 | 병행제도 (시범사업) |
|---|---|---|
| 진행 방식 | 순차적 진행 (직렬) | 동시 진행 (병렬) |
| 총 소요 기간 | 약 210일 이상 | 약 150일 이내 |
| 약가 협상 | 평가 완료 후 60일 | 사전협의 포함 30일 단축 |
| 자료 제출 | 단계별 개별 제출 | 유관기관 자료 공유 |
특히 사전협의 제도의 도입이 신의 한 수라고 생각해요. 건보공단이 미리 협상 테이블에 앉을 수 있게 되면서, 본 협상 기간이 기존 60일에서 30일로 절반이나 뚝 떨어졌거든요.
기간이 짧아졌다고 해서 평가 기준이 느슨해진 것은 절대 아닙니다. 오히려 짧은 시간 내에 고밀도의 검토가 이루어지므로, 자료의 완결성은 이전보다 훨씬 더 중요해졌습니다.
3. 실전 사례: 콰지바와 빌베이 💊
제도가 아무리 좋아도 실제 사례가 없으면 와닿지 않죠. 1차 시범사업의 주인공인 두 약제를 살펴보면 현실적인 감각을 익힐 수 있어요.
📝 1호 시범 약제 현황
- 레코르다티코리아 ‘콰지바주’: 신경모세포종 치료제죠. 우여곡절이 있었지만, 2024년 11월에 등재에 성공하며 병행제도의 첫 결실을 보여주었습니다.
- 입센코리아 ‘빌베이주’: 최근 재심의를 거쳐 약제급여평가위원회를 통과했다는 소식 들으셨죠? 2025년 7월, 드디어 마지막 관문을 향해 가고 있습니다.
이 두 사례는 제도가 실제 ‘작동’하고 있음을 증명합니다. 하지만 동시에, 평가 과정에서의 엄격함은 여전하다는 교훈도 주고 있죠.
4. 제약회사 실무진을 위한 전략적 제언 👩💼
그렇다면 우리 회사는 당장 무엇을 준비해야 할까요? 단순히 ‘신청하면 되겠지’라고 생각하시면 오산이에요. 전략적 접근이 필수입니다.
- 유관기관 소통 채널 확보: 식약처, 심평원, 공단이 자료를 공유합니다. 우리도 이 세 기관과 동시에 소통할 준비가 되어 있어야 해요.
- 경제성 평가 자료의 조기 완성: 허가 신청 시점에 이미 임상적 유용성과 비용효과성 자료가 완벽에 가깝게 준비되어 있어야 합니다. 나중에 보완할 시간이 부족할 수 있어요.
- 재정 영향 분석 강화: 급여 평가 단계부터 공단의 입김이 세지고 있습니다. 보험 재정에 미칠 영향을 미리 철저히 분석해서 방어 논리를 만드세요.
🔢 신약 등재 기간 단축 계산기
우리 회사 신약이 병행제도를 타면 얼마나 빨리 출시될 수 있을까요? 단순 비교해보세요.
자주 묻는 질문 ❓
정부는 이 제도를 통해 제약업계의 혁신을 독려하고 있어요. 우리 실무진들도 이런 정책 변화에 발 빠르게 대응해야만 경쟁력을 확보할 수 있겠죠?
앞으로도 계속 발전할 병행제도의 변화, 저와 함께 계속 모니터링해 봐요. 혹시 우리 회사의 파이프라인에 어떻게 적용할지 고민되시거나 더 궁금한 점이 있다면 언제든 댓글로 물어봐 주세요~ 😊
☆ Disclamer : 작성자 이일형
위 내용은 참고용으로 작성된 것이어서, 정확성을 보장할 수 없습니다.
따라서 위 내용의 정확성에 대해 작성자는 아무런 책임도 지지 않음을 유의하시기 바랍니다.